 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Решение. При уменьшении концентрации Lв три раза, на данный момент времени она будет равна [L] = [L]нач / 3 = 0,12 / 3 =0,4 моль/л
|
|
При уменьшении концентрации L в три раза, на данный момент времени она будет равна [L] = [L]нач / 3 = 0,12 / 3 =0,4 моль/л. Следовательно, в ходе реакции израсходовалось некоторое количество вещества L: [L]изр = [L]нач-[L] = 0,12 – 0,4 = 0,8 моль/л. В случае определения концентрации вещества К следует помнить, что вещество L не расходуется само по себе, а вступает в реакцию с К в соотношении 2 к 1, т. е.  , отсюда х = 0,4 моль/л.
, отсюда х = 0,4 моль/л.
Значит, на данный момент времени концентрация вещества К будет равна [К] = [К]нач - [К]изр = 0,5 – 0,4.= 0,1 моль/л. Также по закону объёмных отношений можно найти и концентрации образованных веществ M и F:
 , отсюда х = 0,12 моль/л.
, отсюда х = 0,12 моль/л.
Концентрацию вещества F можно найти таким же образом по концентрации K или L, а можно и полученной концентрации М:
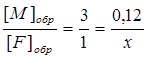 , отсюда х = 0,4 моль/л
, отсюда х = 0,4 моль/л
Поскольку не были даны исходные концентрации этих веществ, то мы можем считать, что начальная концентрация продуктов реакции равна нулю. Следовательно, на тот момент времени, когда концентрация L уменьшилась в три раза, концентрации других веществ будут равны: [К] = 0,1 моль/л;[M] = 0,12 моль/л; [F] =0,4 моль/л.
______________________________________________________________________
СОВЕТ: в формулу закона необходимо подставлять не начальные или конечные концентрации для исходных веществ, а именно израсходованные, прореагировавшие.
2 Химическое равновесие
В химических реакциях исходные вещества не всегда полностью превращаются в продукты реакции. Это происходит потому, что по мере накопления продуктов реакции могут создаваться условия для протекания обратимой реакции в противоположном направлении. Например, если смешать пары иода с водородом при температуре 200 ° С, то произойдет реакция:

Однако известно, что йодистый водород уже при нагревании до 180 °С начинает разлагаться на иод и водород:
 .
.
Понятно, что в этих условиях не произойдет ни полного разложения НI, так как продукты реакции способны вновь реагировать между собой, ни полного образования йодистого водорода.
Основные понятия и законы
Обратимая химическая реакция – это реакция, в ходе которой происходят превращения как в прямом, так и в обратном направлениях, Первым, кто четко сформулировал представление об обратимости химических реакций, был К.Бертолле (1799). Участвуя в Египетской экспедиции Бонапарта, он обратил внимание на образование карбоната натрия в соляных озерах и пришел к заключению, что карбонат натрия образуется в результате взаимодействия между насыщенным раствором хлорида натрия и растворенным карбонатом кальция. Этот процесс обратен проводимой в лаборатории реакции между карбонатом натрия и растворенным хлоридом кальция с образованием карбоната кальция.
При написании уравнений обратимых реакций вместо знака равенства ставят две противоположно направленные стрелки. Уравнение рассмотренной выше обратимой реакции запишется следующим образом:

Реакцию, протекающую слева направо, называют прямой (константа скорости прямой реакции k1), справа налево — обратной (константа скорости обратной реакции k2).
В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем уменьшается вследствие уменьшения концентрации исходных веществ, расходуемых на образование продуктов реакции. И наоборот, обратная реакция в начальный момент имеет минимальную скорость, которая увеличивается по мере увеличения концентрации продуктов реакции. Следовательно, скорость прямой реакции уменьшается, а обратной — увеличивается. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными.

|
Рисунок 4 - График изменения скоростей прямой и обратной реакций во времени 1
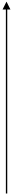 V V1- скорость прямой реакции
V V1- скорость прямой реакции
 V2- скорость обратной реакции
V2- скорость обратной реакции
V1=V2 – состояние химического
равновесия
V1 V1=V2
 |
V2
t(время)
Рисунок 5 - График изменения скоростей прямой и обратной реакций во времени 2
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются. Положение равновесия можно определить, зная скорости прямой и обратной реакций. Уравнение обратимой реакции имеет вид


согласно закону действующих масс, скорости прямой реакции u1 и обратной u2 соответственно запишутся следующим образом:

В равновесии скорости прямой и обратной реакций равны:
k1[A]m[B]n= k2[C]p[D]q.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций. Преобразуем эту формулу и получим:
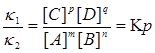 .
.
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции, т. е. численное значение константы равновесия характеризует тенденцию к осуществлению реакции или, другими словами, характеризует выход данной реакции. Так, при К >> 1 выход реакции велик (равновесие смещено в сторону прямой реакции), так как при этом

Понятно, что при К << 1 выход реакции мал (.равновесие смещено в сторону обратной реакции).
Дата публикования: 2015-07-22; Прочитано: 308 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
