 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Влияние изменения давления на состояние равновесия
|
|
Из экспериментальных данных (рис. 19) следует, что процентное содержание аммиака в системе с повышением давления (Р) возрастает при любой температуре.
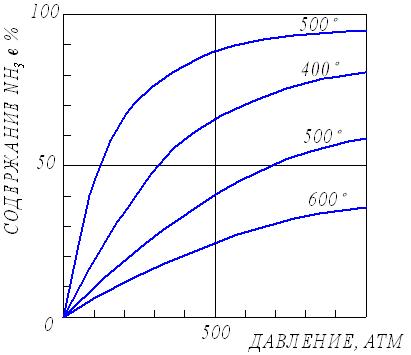
Рис.19. Влияние температуры и давления на состояние
химического равновесия при синтезе аммиака.
Сопоставим эти данные с изменением числа молекул в газовой смеси:
повышение внешнего давления
¾¾¾¾¾¾¾¾®
уменьшение общего числа молекул
N2(г) + 3H2(г) «2NH3(г)
понижение внешнего давления
¾¾¾¾¾¾¾-
увеличение общего числа молекул
В левой части уравнения всего 4 моль газов, а в правой - 2. Четыре моль газа при данной температуре и давлении, согласно закону Авогадро, займут объем в два раза больший, чем два моль. Следовательно, процесс синтеза аммиака сопровождается уменьшением общего числа молекул, что приводит к уменьшению объема системы. Этот процесс, как видно из экспериментальных данных, усиливается при повышении давления.
Уменьшение давления действует, соответственно, в обратном направлении: усиливая процесс разложения аммиака, оно способствует увеличению общего числа молекул в системе согласно уравнению
2NH3 «3H2 + N2,
откуда видно, что из двух молекул образуется четыре молекулы: одна – азота и три – водорода.
Обобщая, можно сформулировать следующее:
а) если реакция идет с изменением числа молекул газов, то давление влияет на ее скорость и, следовательно, вызывает нарушение равновесия,
б) повышение давления увеличивает скорость реакции, протекающей с понижением давления, и, соответственно, наоборот.
Значения равновесных концентраций веществ в системе
H2(г) + Cl2(г) «2HCl(г)
при изменении давления остаются постоянными (по два моль газов в обеих частях уравнения).
Дата публикования: 2015-07-22; Прочитано: 428 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
