 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Уравнение Аррениуса
|
|
Это уравнение, предложенное шведским учёным Аррениусом в 1889 году, выражает одновременно зависимость скорости реакции от энергии активации, температуры, а также энтропии активации реакции:
 (1.20)
(1.20)
Входящие в это уравнение величины k, Ea, T, R определены ранее. Величина 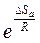 выражает так называемый стерический фактор, который также может существенно влиять на скорость реакции. Его смысл в том, что, кроме обладания энергией активации, для осуществления реакции необходимо, чтобы молекулы при столкновении были определённым образом (благоприятно) ориентированны друг относительно друга в пространстве. Это можно проиллюстрировать на примере реакции
выражает так называемый стерический фактор, который также может существенно влиять на скорость реакции. Его смысл в том, что, кроме обладания энергией активации, для осуществления реакции необходимо, чтобы молекулы при столкновении были определённым образом (благоприятно) ориентированны друг относительно друга в пространстве. Это можно проиллюстрировать на примере реакции
H2 + I2 ® 2HI

а) б)
Рис 11. Благоприятные (а) и неблагоприятные (б) столкновения молекул H2 и I2
Другим примером роли стерического фактора может служить уменьшение скорости реакции этерификации (спирт + кислота ® сложный эфир + вода) при переходе от первичных спиртов к третичным. Третичные спирты (R3C-OH) имеют более сложное пространственное строение, чем первичные (RСН2–OH), поэтому возможность их благоприятной ориентации по отношению к молекулам кислоты менее вероятна.
Величина ΔSa называется энтропией активации (Дж/моль·К), она пропорциональна отношению числа благоприятных способов ориентации к их общему возможному числу:

Отсюда очевидно, что чем жёстче требования ориентации, тем меньше будет величина ΔSa, а значит и скорость реакции. Значение стерического фактора особенно сказывается на реакциях с участием сложных молекул с разветвлённой структурой.
Z – множитель, отражающий общее число столкновений взаимодействующих частиц. Произведение 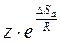 часто обозначают как А и называют предэкспоненциальным множителем, тогда уравнение (1.20) записывается:
часто обозначают как А и называют предэкспоненциальным множителем, тогда уравнение (1.20) записывается:
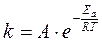 (1.21)
(1.21)
Определение энергии активации. Прологарифмировав уравнение Аррениуса, получим:
 (1.22)
(1.22)
Если построить график зависимости экспериментальных величин lg k от 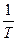 , то получим прямую, отсекающую на оси ординат отрезок, равный lgA (откуда можно определить А) и имеющую наклон, равный
, то получим прямую, отсекающую на оси ординат отрезок, равный lgA (откуда можно определить А) и имеющую наклон, равный 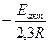 (откуда можно определить Ea) (рис. 12):
(откуда можно определить Ea) (рис. 12):

Рис.12. Графический расчет энергии активации
Следовательно, для определения энергии активации необходимо иметь опытные данные по значениям константы скорости при нескольких температурах. Их представляют в виде таблицы:
| k | lgk | T | 1/T |
и строят график зависимости  .
.
Если известны только два значения константы скорости k1 и k2 при Т1 и Т2 соответственно, то уравнение (1.22) для этого случая запишется следующим образом:
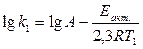 (1.23)
(1.23)
 (1.24)
(1.24)
Вычитая уравнение (1.24) из (1.23), получим:
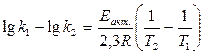
или
Еа = 2,3RT1T2.lg(k2/k1)/(T2-T1 ) (1.25)
Уравнение Аррениуса, таким образом, математически выражает важнейшие положения, вытекающие из теории активных столкновений:
1) чем больше концентрация реагирующих веществ, тем выше скорость реакции (тем больше число столкновений);
2) чем больше энергия активации реакции, тем её скорость меньше (тем меньше доля активных молекул);
3) повышение температуры увеличивает скорость реакции (увеличивается доля активных молекул);
4) чем выше энергия активации, тем быстрее увеличивается скорость реакции с ростом температуры (быстрее увеличивается доля молекул с большими энергиями);
5) чем проще строение молекул, тем выше скорость реакции (тем больше доля благоприятных взаимных ориентаций молекул в пространстве).
Дата публикования: 2015-07-22; Прочитано: 2447 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
