 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Приведите решение и выберите номер правильного ответа
|
|
58. Через 30 секунд после начала реакции, протекающей по уравнению А 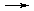 В количество вещества А уменьшилось от 0,5 до 0,2 моль. скорость реакции равна (в моль/с)
В количество вещества А уменьшилось от 0,5 до 0,2 моль. скорость реакции равна (в моль/с)
1) 10-5
2) 10-4
3) 10-3
4) 10-2
5) 10-1
59. в момент достижения химического равновесия в системе Н2 газ + Сl2 газ ⇄ 2НСl газ концентрации всех веществ составили 0,6 моль/л. константа равновесия равна
1) 0,6
2) 1
3) 6
4) 10
5) 11
60. При увеличении температуры от 300С до 500С скорость затвердения пломбировочного материала увеличилась в 6,25 раза. при понижении температуры на 100С скорость этого процесса уменьшится В
1) 1,25 раза
2) 2
3) 2,5
4) 3
5) 3,5
61. состояние химического равновесия в системе N2 газ + 3Н2 газ ⇄ 2NН3 газ достигается в момент времени, когда концентрации веществ составили: [N2] = 3 моль/л, [Н2] = 6 моль/л, [NH3] = 9 моль/л. исходные концентрации Н2 и N2 соответственно равны (в моль/л)
1) 20 и 80
2) 19,5 и 7,5
3) 1,95 и 0,75
4) 2,0 и 0,80
5) 20 и 0,08
62. при изотермическом повышении давления в реакторе в 4 раза скорость прямой газофазной реакции: 2A + B  2C, имеющей первый порядок по веществу а и по веществу в
2C, имеющей первый порядок по веществу а и по веществу в
1) уменьшится в 4 раза
2) увеличится в 8
3) увеличится в 16
4) уменьшится в 32
5) увеличится в 64
63. В системе H2 газ + Br2 газ ⇄ 2HBr газ в состоянии равновесия концентрации веществ составили: [H2] = 0,4 моль/л, [Br2] = 0,2 моль/л, [HBr] = 0,8 моль/л. константа равновесия равнА
1) 0,125
2) 0,8
3) 1
4) 1,25
5) 8
64. Период полуэлиминации препарата мебикар равен 3 ч (реакция первого порядка). 75% препарата будет выведено из организма через
1) 0,5 часа
2) 1,5
3) 3
4) 6
5) 9
65. при определенных условиях Константа равновесия В системе Н2 газ + I2 газ ⇄ 2HI газ равна 4. при условии, что [h2] = [I2] = 0,1 моль/л, равновесная концентрация HI равна (в моль/л)
1) 0,02
2) 0,04
3) 0,2
4) 0,4
5) 1
66. реакция гидролиза этилового эфира фенилаланина имеет первый кинетический порядок. константа скорости этой реакции равна 2,67×10-3 с-1. период полупревращения реакции равЕн (В секундах)
1) 120
2) 180
3) 220
4) 260
5) 520
67. состояние химического равновесия в системе 2NO газ + O2 газ ⇄ 2NO2 газ достигается в момент времени, когда концентрации веществ равны: [NO] = 4 моль/л, [O2] = 6 моль/л, [NО2] = 10 моль/л. исходные концентрации NO и O2 соответственно равны (в моль/л)
1) 5 и 10
2) 10 и 5
3) 11 и 14
4) 14 и 11
5) 11 и 11
68. В элементарной реакции A + B 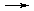 С + D в определенный момент времени скорость реакции составила 0,15 моль/л×с, а концентрации веществ A и B соответственно 5 и 3 моль/л. константа скорости этой реакции равна (в л/моль×с)
С + D в определенный момент времени скорость реакции составила 0,15 моль/л×с, а концентрации веществ A и B соответственно 5 и 3 моль/л. константа скорости этой реакции равна (в л/моль×с)
1) 5×10-3
2) 10-2
3) 5×10-2
4) 10-1
5) 1
69. В обратимой реакции C2H2 газ + 2H2 газ ⇄ C2H6 газ равновесие установилось при следующих концентрациях веществ: [C2H2] = 0,2 моль/л, [H2] = 0,1 моль/л и [C2H6] = 0,3 моль/л. константа равновесия равна
1) 1,5
2) 10
3) 15
4) 100
5) 150
70. при аффинаже золота реакция растворения примеси меди разбавленной азотной кислотой при 200С протекает за 24 минуты. если температурный коэффициент равен 2, ТО при 500С эта реакция закончится за время (в минутах)
1) 2
2) 3
3) 5
4) 8
5) 16
71. В обратимой реакции CO газ + 2H2 газ ⇄ CH3OH газ равновесие установилось при следующих концентрациях веществ: [CO] = 0,8 моль/л, [H2] = 1 моль/л и [CH3OH] = 0,6 моль/л. исходные концентрации CO и H2 соответственно равны (в моль/л)
1) 1,4 и 2,2
2) 2,2 и 1,4
3) 14 и 22
4) 22 и 14
5) 14 и 14
72. В элементарной реакции 2А + В 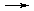 2С начальные концентрации А и B соответственно равны 0,8 и 0,7 моль/л. Константа скорости k = 1,5 л2/моль2×мин. в начальный момент времени скорость данной реакции равна (в моль/л×мин)
2С начальные концентрации А и B соответственно равны 0,8 и 0,7 моль/л. Константа скорости k = 1,5 л2/моль2×мин. в начальный момент времени скорость данной реакции равна (в моль/л×мин)
1) 0,24
2) 0,56
3) 0,67
4) 0,84
5) 1,68
73. для реакции CO2 газ + H2 газ ⇄ CO газ + H2O пар известно, что Kc = 0,5, [CO2] = [CO] = 0,1 моль/л. исходные концентрации CO2 и H2 соответственно равны (в моль/л)
1) 0,2 и 0,3
2) 0,3 и 0,2
3) 0,2 и 0,4
4) 0,4 и 0,2
5) 0,1 и 0,2
74. Лекарственный препарат на испытании в условиях ускоренного старения при 500С показал срок годности 50 суток. если температурный коэффициент реакции деструкции препарата равен 2, то в условиях складского хранения при 200С срок годности этого препарата составит
1) 6 суток
2) 12
3) 25
4) 200
5) 400
75. при определенных условиях Константа химического равновесия реакции N2 газ + 3H2 газ ⇄ 2NH3 газ равна 5. если [NH3] = [H2] = 0,4 моль/л, то равновесная концентрациЯ N2 равнА (в моль/л)
1) 0,05
2) 0,1
3) 0,2
4) 0,5
5) 1
76. Период полуэлиминации препарата равен 6 ч (реакция первого порядка). 87,5% препарата будет выведено из организма через
1) 2 часа
2) 3
3) 6
4) 12
5) 18
77. Для реакции N2O4 газ ⇄ 2NO2 газ известно, что Kc = 4, [N2O4] = 1 моль/л. равновесная концентрация NO2 равна (в моль/л)
1) 1
2) 1,5
3) 2
4) 3
5) 4
78. реакция описывается уравнением 2A(газ) + B(газ)  2C(газ) и имеет второй порядок по веществу А и первый по веществу в. чтобы в изотермических условиях повысить скорость реакции в 64 раза необходимоувеличить давление в
2C(газ) и имеет второй порядок по веществу А и первый по веществу в. чтобы в изотермических условиях повысить скорость реакции в 64 раза необходимоувеличить давление в
1) 2
2) 3
3) 4
4) 8
5) 16
79. В обратимой реакции А газ + В газ ⇄ АВ газ равновесие установилось при концентрациях: [А] = 0,1 моль/л, [В] = 0,4 моль/л и [АВ] = 4 моль/л. исходные концентрации веществ А и В соответственно равны (в моль/л)
1) 0,41 и 44
2) 4,1 и 4,4
3) 5 и 6
4) 41 и 44
5) 41 и 4,4
80. при повышении температуры на 200С скорость реакции увеличилась в 6,25 раза. температурный коэффициент этой реакции равен
1) 2
2) 2,5
3) 3
4) 3,5
5) 4
81. при определенных условиях В системе Н2 газ + I2 газ ⇄ 2HI газ Равновесные концентрации веществ составили: [H2] = 0,004 моль/л, [I2] = 0,025 моль/л, [HI] = 0,08 моль/л. константа химического равновесия равна
1) 0,64
2) 6,4
3) 64
4) 128
5) 256
82. реакция протекает по уравнению A + 2B  C и имеет первый порядок по веществам A и B. если k = 0,5 л/(моль×с) и с(А) = с(B) = 0,2 моль/л, то начальная скорость реакции равна (моль/л×с)
C и имеет первый порядок по веществам A и B. если k = 0,5 л/(моль×с) и с(А) = с(B) = 0,2 моль/л, то начальная скорость реакции равна (моль/л×с)
1) 0,0005
2) 0,004
3) 0,005
4) 0,01
5) 0,02
83. при стандартных условиях равновесие в системе 2NO газ + O2 газ ⇄ 2NO2 газ установилось при следующих концентрациях: [NO2] = 1 моль/л, [NO] = 0,01 моль/л и [O2] = 0,1 моль/л. константа равновесия равна
1) 10-5
2) 5×10-3
3) 5
4) 500
5) 105
84. период полуэлиминации препарата составляет 4 часа. Если этот процесс подчиняется кинетике первого порядка, то 75% препарата будет выведено из организма через
1) 1,5 часа
2) 3
3) 6
4) 8
5) 12
85. В обратимой реакции А + В ⇄ 2С равновесие установилось в момент времени, когда прорегировало 50% вещества А. если начальные концентрации а и в были равны и составили 1 моль/л, то равновесные концентрации [А], [В] и [С] соответственно равны (в моль/л)
1) 0,5; 0,5; 0,5
2) 0,5; 0,5; 1
3) 1; 0,5; 0,5
4) 0,5; 1; 0,5
5) 0,5; 1; 1
86. При 200С реакция продолжалась 4 мин 16 секунд. Если g = 2, то за 8 секунд эта реакция закончится при температуре (в 0С)
1) 40
2) 50
3) 60
4) 70
5) 80
87. диссоциация уксусной кислоты протекает по уравнению:
CH3COOH ⇄ CH3COO- + H+. В момент достижения состояния равновесия концентрации компонентов составили: [CH3COOH] = 10-1 моль/л; [CH3COO-] = [H+] = 10-3 моль/л. константа равновесия равна
1) 10-5
2) 5×10-3
3) 5
4) 500
5) 105
88. в реакции, которая описывается уравнением 2A + B  2C и имеет второй порядок по веществу А и первый по веществу в, концентрацию вещества а увеличили в 2 раза. при условии, что Т = const скорость реакции
2C и имеет второй порядок по веществу А и первый по веществу в, концентрацию вещества а увеличили в 2 раза. при условии, что Т = const скорость реакции
1) не изменится
Дата публикования: 2015-07-22; Прочитано: 2017 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
