 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Раствор Ме
|
|
Задача.
Рассчитать рН 0,05 М раствора НСN.
НСN Û Н+ + СN- - слабая кислота с о = 0,05 моль/л
К Д= 7,9×10-10 (из таблицы)
a = 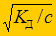 =
= 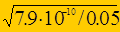 = 1,26×10-4.
= 1,26×10-4.
сH + = a со = 1,26×10-4×0,05 = 6,3×10-6
рН = ‑lg с H+ = - lg 6,3×10-6 = 5,18.
Задача
Рассчитать рН 0,05 М раствора NаОН.
Решение
NаОН ® Nа+ + ОН- - сильное основание
с: 0,05 0,05 0,05 моль/л
I = 1/2(0,05×12 + 0,05×12) = 0,05.
gОН- = 0,85 (по таблице)
а ОН- = gОН- ×с OH- = 0,85×0,05 = 0,043
рН = 14 + lg а ОН - = 14 - 1,37 = 12,63.
| Индикатор | Область рH | Окраска | |
| В кислом растворе | В щелоч растворе | ||
| Пикриновая кислота Метиловый оранжевый Лакмус Феноловый красный Фенолфталеин Ализариновый желтый | 0,0-2,0 3,1-4,4 6,0-8,0 6,8-8,4 8,2-10,0 10,1-12,1 | Бесцветная Красная >> Желтая Бесцветная Желтая | Желтая >> Синяя Красная Малиновая Оранжевая |

две группы электрохимических систем:
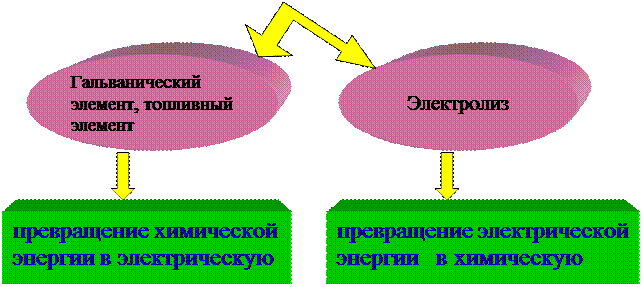
Общее:
1. окислительно-восстановительная реакция - электрохимическая реакция;
2.пространственная локализация электронных переходов;
3.процессы восстановления и окисления разделены.


 | |||
 | |||
 |  | ||
Ионный проводник - раствор, расплав или твердый электролит.
 Электроды - металлические или полупроводниковые материалы.
Электроды - металлические или полупроводниковые материалы.
 | |||
 | |||


1833г. англ. и уч. М.Фарадей

k – электрохимический эквивалент;
q = I×t - количество электричества, Кл;
I - силатока, прошедшего через систему, А;
t – время протекания процесса, с или час.;

m( 1)/m(2) = MЭ(1)/МЭ(2), m (1)/ MЭ (1) = m (2) /MЭ (2)
nЭ (1) моль экв.= nЭ (2) моль экв.
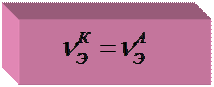

F= 96500 Кл (А×с),
- для массы вещества:
МЭ – молярнаямасса эквивалента вещества, г/моль,; 
n – число электронов, участвующих в процессе;
-для объема газообразных веществ:
VЭ – объем моль-эквивалента газа, л/моль;
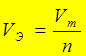
При (н.у.) 1 моль газа - 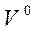 m = 22,4 л,
m = 22,4 л,

Одним из важнейших элементов внутренней цепи является граница раздела электрод-ионный проводник.
Что происходит при погружении Ме в раствор собственных ионов?
Ме: Меn+×nе Û Меn+ + nе
а) Ме + mН2О ® Меn+× (Н2О)m+ne

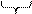
 Ме
Ме
раствор Ме
D G < 0
б) диффузия Меn+ в раствор;
в) образуется двойной электрический
слой, на Ме (-), в растворе (+);
г) на границе Ме – раствор возникает
скачок потенциалов:
(Y 2- Y 1) = Е Меn+/Ме -
- электродный потенциал;
Знак потенциала – заряд на Ме
(1953г – ИЮПАК)
д) устанавливается равновесие:
Ме + mН2О Û Меn+× (Н2О)m+ne
Jвыхода Меn+ = Jадсорб Меn+ - возникает
равновесный электродный потенциал:
ЕР Меn+/Ме
Способность посылать Меn+ в раствор зависит:
Ме (к) ® Ме (г); (-Qсублимации)
Ме (г) ® Меn+ (г) +ne; (-Iионизации)
Меn+ (г) +aq ®Меn+×aq; (+Qгидратации)


 Чем Qсубл, Iиониз и Qгидр, тем больше способность
Чем Qсубл, Iиониз и Qгидр, тем больше способность
Ме посылать ионы Меn+ в раствор и ниже электродный потенциал Е Меn+/Ме

1) акт.Ме (Fe, Zn) Þ переход ионов в раствор Þ (- Е);
Ме ® Меn+ + ne
раствор Ме
2) неакт. Ме (Cu, Ag) Þ адсорбция ионов из раствора Þ (+ Е);
 Меn+ + ne ® Ме
Меn+ + ne ® Ме
3) благор.Ме (Au, Pt) Þ Qсубл и Iиониз Þ разность потенциалов не возникает за счет перехода ионов Þ
Þ может за счет адсорбции молекул газа Þ
Þ газовые электроды.
 Н+р-р / Н2;Pt
Н+р-р / Н2;Pt
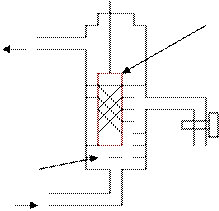
Pt /Pt: адсорбция Н2
H2 на границе Ме-раствор:
потенциалопределяющая
реакция:
2Н+ + 2е Û Н2; Е Н+/Н2
H+
H2
Абсолютное значение электродного потенциала определить нельзя.
Условно считают, если стандартное состояние:
рН2 = 1 (101кПа)
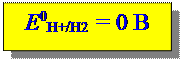 а Н+ = 1моль/л
а Н+ = 1моль/л
Т = 298 К
Þ измеряют относительные значения электродных потенциалов - относительно электрода сравнения, потенциал которого известен, например, Е 0Н+/Н2 = 0 В.

О2,Pt / ОН-р-р
окисленная восстановленная
форма форма
На границе Ме-раствор:
потенциалопределяющая реакция: О2 + 2Н2О + 4е Û 4ОН-
Е0О2/ОН-= 0,401 В



водородная шкала потенциалов:
чем меньше потенциал, тем активнее частица

потенциалопределяющая реакция: Ox + neÛ Red
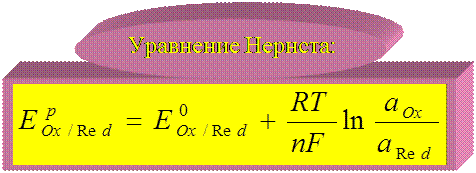
R – универсальная газовая постоянная, 8,31Дж/моль.К;
n – число электронов, принимающих участие в реакции
F – число Фарадея, 96500 Кл/моль (26,8 А .час/моль);
T – температура, К.
Уравнение Нернста для металлических электродов:
потенциалопределяющая реакция:
Mе(р-р)n+ + n 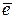
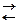 Mе(к).
Mе(к).

Для Т = 298 К и переходя к десятичному логарифму:
 |
Уравнение Нернста для водородного электрода:
потенциалопределяющая реакция: 2Н+ + 2е 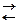 Н2
Н2
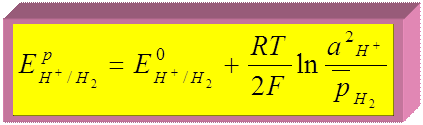
Т.к. 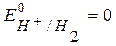 ,
,  , Т = 298 К
, Т = 298 К


Если  Þ
Þ
Уравнение Нернста для кислородного электрода
потенциалопределяющая реакция:
О2 + 4 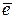 + 2Н2О
+ 2Н2О 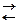 4ОН–
4ОН–
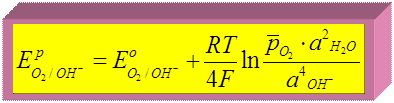 |
Т.к. 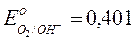 В, Т = 298 К,
В, Т = 298 К, 
 |
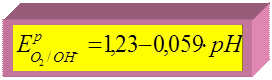 Если
Если 
 Þ
Þ

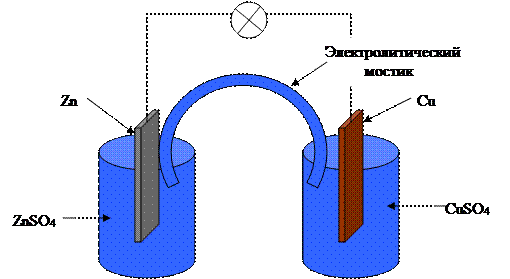
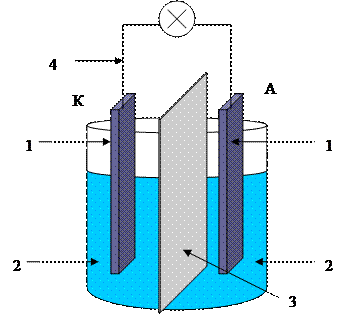 СХЕМА ГЭ
СХЕМА ГЭ
1 - электроды: катод К и анод А;
2 - растворы солей;
3 - диафрагма, проницаемая для ионов;
4 - внешнюю цепь (металлические проводники).
 |
В отсутствии тока (разомкнутая цепь) Þ
равновесие на границе Ме-раствор:
А: Mе1(р-р)n+ + n 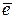
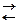 Mе1(к), Е рА
Mе1(к), Е рА
К: Mе2(р-р)n+ + n 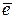
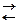 Mе2(к), Е рк
Mе2(к), Е рк


стандартная ЭДС ГЭ: 

При замыкании цепи Þ
равновесие нарушается:

 А: Mе1(к) ® Mе1(р-р)n+ + n
А: Mе1(к) ® Mе1(р-р)n+ + n 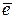 , Еi А
, Еi А
К: Mе2(р-р)n+ + n 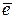 ® Mе2(к), Еi к
® Mе2(к), Еi к


 Mе1(к) + Mе2(р-р)n+ + n
Mе1(к) + Mе2(р-р)n+ + n 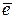 ® Mе1(р-р)n+ + n
® Mе1(р-р)n+ + n 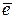 + Mе2(к) Þ
+ Mе2(к) Þ
уравнение токообразующей реакции (ТОР):
Mе1(к) + Mе2(р-р)n+ ® Mе1(р-р)n+ + Mе2(к)
 | |||
 |
При разомкнутой цепи Þ равновесие:
Zn2+ + 2e 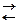 Zn
Zn
Cu2+ + 2e 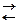 Cu
Cu
Е0 Cu2+/Cu = 0,337 B; Е0 Zn2+/Zn = -0,763 B
|
|
Zn2+/Zn –
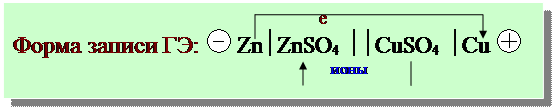
Цепь замкнута:
А: Zn → Zn2+ + 2e -окисление
К: Cu2+ + 2e → Cu -восстановление
ТОР: Zn + Сu2+ → Zn2+ + Cu
 |

 | |||
 |

D Е = Еi – Еp
D ЕA = ЕAi – ЕAp
D ЕK = ЕKi – ЕKp
Из закона Фарадея Þ ток (I) пропорционален количеству вещества, прореагировавшему на электродах в единицу времени, т.е. скорости электрохимической реакции:
 Þ значение I для оценки скорости
Þ значение I для оценки скорости
Строят график зависимости Е =f(i) –
- поляризационные кривые

Для получения большего тока Þ большее отклонение от равновесного значения Þ большее значение поляризации


 Чем D Е Þ I Þ скорость.
Чем D Е Þ I Þ скорость.
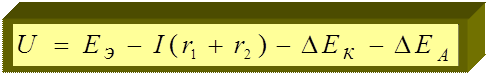
U – напряжение ГЭ;
I(r1 + r2) - омическое падение напряжения;
r1- сопротивлениев проводниках с электронной;
проводимостью (проводники первого рода);
r2- сопротивление в электролите (проводник второго рода);
При прохождении электрического тока:
Е анода Þ более положительным,
Е катода Þ более отрицательным Þ
напряжение U - уменьшается.

 | |||||
 |  | ||||

а s,v – активность ионов в приэлектродном слое(s) или
в объеме раствора (v)
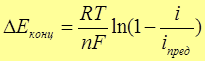
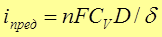
D – коэффициент диффузии реагента
d - толщина диффузного слоя


 1) D; 2) Сv; 3) d; 4)перемешивать
1) D; 2) Сv; 3) d; 4)перемешивать

а, в – завист от реакции, температуры, рН, Sэлектродов
|
 |
1) Среагентов
 2) температуру
2) температуру
3) использовать электроды-kt
 |
4) Sэлектродов
 Цель Þ U Þ для этого необходимо:
Цель Þ U Þ для этого необходимо:
1)  ЭДС;
ЭДС;
2)  поляризацию;
поляризацию;
3)  омические потери, для чего:
омические потери, для чего:


 а) I; b) r1 и r2 – за счет расстояния между электродами, использовать добавки увеличивающие электропроводность электролита.
а) I; b) r1 и r2 – за счет расстояния между электродами, использовать добавки увеличивающие электропроводность электролита.

 Электролизер
Электролизер

1. Катод-

Анод -
2. Электролит
3. источник
Е анода Þ более положительным
Е катода Þ более отрицательным
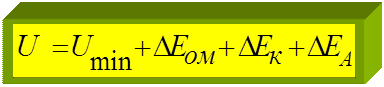 |
U - напряжение, которое необходимо подать на электроды от внешнего источника постоянного тока;
D Е ом = r .I - омическое падение напряжения на внутреннем сопротивлении электрохимической цепи (r)
U – можно снизить:
 1) r внутр.: расстояние между электродами, применяя добавки повышающие эл/проводность электролита;
1) r внутр.: расстояние между электродами, применяя добавки повышающие эл/проводность электролита;

 2) поляризацию: S электродов – сделать более пористой, перемешивать, силу тока, Т.
2) поляризацию: S электродов – сделать более пористой, перемешивать, силу тока, Т.

 |  |
 |  |

 |
Растворимый(активный) нерастворимый(неактивный)
Zn, Cu, Fe, Cd, Ag, Ni и др. Pt, Pd, Сгр
При отличии равновесных потенциалов < 1,0 В на электродах возможно протекание нескольких процессов.

|
qj – количество электричества, пошедшее на конкретный процесс;
q – общее количество электричества, прошедшее через электрохимическую систему.
 | |||
 |

nMе + mOx → MеnRedm 
Þ возможность протекания процесса коррозии, но не дает реальных представлений о скорости коррозии.
4Al + 3O2 + 6H2О = 4Al(OH)3 , 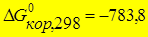 кДж < 0.
кДж < 0.
Þ Al - интенсивно корродирует под действием О2.
Þ Al - конструкционный материал.
Причина – продукты коррозии - оксидные, гидроксидные, солевые и др. пленки тормозят дальнейший процесс коррозии-
-пассивация металла.

Поверхность Ме энергетически неоднородна.
На участках, имеющих более отрицательное значение Е Þ окисление Ме Þ анодные участки коррозионных гальванических элементов:
А: Ме → Меn+ + n 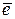 .
.
На участках, имеющих более положительное значение Е Þ восстановление окислителей, присутствующих в окружающей среде Þ катодные участки:
K: Ox + n 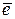 → Red.
→ Red.
Самые распространенные окислители:
а) О2 воздуха, растворенный в электролите
б) ионы Н+.
- кислородная деполяризация:
O2 + 2H2O + 4 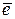 → 4OH- pH ³ 7
→ 4OH- pH ³ 7
O2 + 4H+ + 4 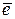 → 2H2O pH < 7
→ 2H2O pH < 7
- водородная деполяризация:
2H+ + 2 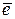 → H2 pH < 7
→ H2 pH < 7
2H2O + 2 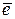 → H2 + 2OH– pH ³ 7
→ H2 + 2OH– pH ³ 7
Энергия Гиббса коррозии: 
ЭДС коррозионного гальванического элемента:
 ,
,


Задача
Имеется спай Sn с Ag.
Определить возможность коррозии при эксплуатации изделия в щелочной среде (рН = 9) при контакте с кислородом. Написать уравнения коррозионных процессов.
Дата публикования: 2015-07-22; Прочитано: 514 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!

