 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Свойства металлов
|
|
Щелочные металлы – это серебристо-белые вещества с характерным металлическим блеском. Они быстро тускнеют на воздухе из-за окисления. Это мягкие металлы, по мягкости Na, K, Rb, Cs подобны воску. Они легко режутся ножом. Они легкие. Литий – самый легкий металл с плотностью 0,5 г/см3.
Химические свойства щелочных металлов
1. Взаимодействие с неметаллами
Из-за высоких восстановительных свойств щелочные металлы бурно реагируют с галогенами с образованием соответствующего галогенида. При нагревании реагируют с серой, фосфором и водородом с образованием сульфидов, гидридов, фосфидов.
2Na + Cl2→ 2NaCl
2Na + S 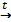 Na2S
Na2S
2Na + H2 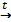 2NaH
2NaH
3Na + P 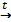 Na3P
Na3P
Литий – это единственный металл, который реагирует с азотом уже при комнатной температуре.
6Li + N2 = 2Li3N, образующийся нитрид лития подвергается необратимому гидролизу.
Li3N + 3H2O → 3LiOH + NH3↑
2. Взаимодействие с кислородом
Только с литием сразу образуется оксид лития.
4Li + О2 = 2Li2О, а при взаимодействии кислорода с натрием образуется пероксид натрия.
2Na + О2 = Na2О2. При горении всех остальных металлов образуются надпероксиды.
К + О2 = КО2
3. Взаимодействие с водой
По реакции с водой можно наглядно увидеть, как изменяется активность этих металлов в группе сверху вниз. Литий и натрий спокойно взаимодействуют с водой, калий – со вспышкой, а цезий – уже с взрывом.
2Li + 2H2O → 2LiOH + H2↑
4. Взаимодействие с кислотами – сильными окислителями
8K + 10HNO3 (конц) → 8KNO3 + N2O +5 H2O
8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O
Получение щелочных металлов
Из-за высокой активности металлов, получать их можно при помощи электролиза солей, чаще всего хлоридов.
Соединения щелочных металлов находят большое применение в разных отраслях промышленности. См. Табл. 1.
| РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ | |
| NaOH | Едкий натр (каустическая сода) |
| NaCl | Поваренная соль |
| NaNO3 | Чилийская селитра |
| Na2SO4∙10H2O | Глауберова соль |
| Na2CO3∙10H2O | Сода кристаллическая |
| KOH | Едкое кали |
| KCl | Хлорид калия (сильвин) |
| KNO3 | Индийская селитра |
| K2CO3 | Поташ |
3. Щелочноземельные металлы
Их название связано с тем, что гидроксиды этих металлов являются щелочами, а оксиды раньше называли «земли». Например, оксид бария BaO – бариевая земля. Бериллий и магний чаще всего к щелочноземельным металлам не относят. Мы не будем рассматривать и радий, так как он радиоактивный.
Химические свойства щелочноземельных металлов.
1. Взаимодействие с неметаллами
Сa + Cl2→ 2СaCl2
Сa + S 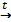 СaS
СaS
Сa + H2 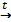 СaH2
СaH2
3Сa + 2P 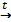 Сa3 P2-
Сa3 P2-
2. Взаимодействие с кислородом
2Сa + O2 → 2CaO
3. Взаимодействие с водой
Sr + 2H2O → Sr(OH)2 + H2↑, но взаимодействие более спокойное, чем с щелочными металлами.
4. Взаимодействие с кислотами – сильными окислителями
4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O
4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O
Получение щелочноземельных металлов
Металлический кальций и стронций получают электролизом расплава солей, чаще всего хлоридов.
CaCl2 Сa + Cl2
Барий высокой чистоты можно получить алюмотермическим способом из оксида бария
3BaO +2Al 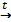 3Ba + Al2O3
3Ba + Al2O3
РАСПРОСТРАНЕННЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Самыми известными соединениями щелочноземельным металлов являются: CaО – негашеная известь. Ca(OH)2 – гашеная известь, или известковая вода. При пропускании углекислого газа через известковую воду происходит помутнение, так как образуется нерастворимый карбонат кальция СаСО3. Но надо помнить, что при дальнейшем пропускании углекислого газа образуется уже растворимый гидрокарбонат и осадок исчезает.

Рис. 2
СaO + H2O → Ca(OH)2
Ca(OH)2 + CO2↑ → CaCO3↓+ H2O
CaCO3↓+ H2O + CO2 → Ca(HCO3)2
Гипс – это CaSO4∙2H2O, алебастр – CaSO4∙0,5H2O. Гипс и алебастр используются в строительстве, в медицине и для изготовления декоративных изделий. Рис. 2.
Карбонат кальция CaCO3 образует множество различных минералов. Рис. 3.

Рис. 3
Фосфат кальция Ca3(PO4)2 – фосфорит, фосфорная мука используется как минеральное удобрение.
Чистый безводный хлорид кальция CaCl2 – это гигроскопичное вещество, поэтому широко применяется в лабораториях как осушитель.
Карбид кальция – CaC2. Его можно получить так:
СaO + 2C →CaC2 +CO. Одно из его применений – это получение ацетилена.
CaC2 + 2H2O →Ca(OH)2 + C2H2↑
Сульфат бария BaSO4 – барит. Рис. 4. Используется как эталон белого в некоторых исследованиях.

Рис. 4
Дата публикования: 2015-07-22; Прочитано: 408 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
