 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Неравновесная электрохимия. Электролиз
|
|
Электролиз — это процесс, в котором химические реакции происходят под действием электрического тока, подаваемого от внешнего источника. При электролизе происходит превращение электрической энергии в химическую. Ячейка для электролиза, называемая электролизером, состоит из двух электродов электролита. Электрод, на котором идет реакция восстановления (катод), у электролизера подключен к отрицательному полюсу внешнего источника. Электрод, на котором протекает реакция окисления (анод), подключен к положительному полюсу источника тока.

Рассмотрим электродные реакции на примере электролиза расплава NaCl. При плавлении происходит термохимическая диссоциация соли:
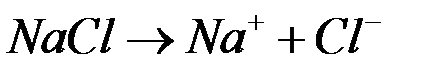
Если погрузить в расплавленную соль два графитовых электрода и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов и на электродах будут протекать следующие реакции:
а) восстановление ионов  до металлического
до металлического 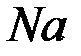 (катодный процесс) на отрицательном электроде, т.е. электроде, на которой поступает элементы от внешнего источника тока:
(катодный процесс) на отрицательном электроде, т.е. электроде, на которой поступает элементы от внешнего источника тока:
 ;
;
б) окисление хлорид-ионов 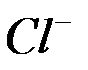 до
до 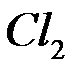 (анодный процесс) на положительном электроде, с которого электроны идут во внешнее цепь:
(анодный процесс) на положительном электроде, с которого электроны идут во внешнее цепь:
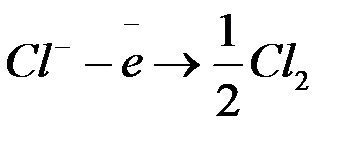 .
.
Суммарная реакция 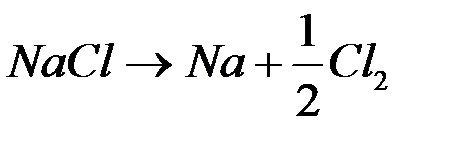 .
.
Электролиз подчиняется законом Фарадея:
Первый закон: 1)количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
Второй закон: 2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
При превращении одного моля эквивалентов вещества на электроде через него проходит ≈96500 Кл(А*с). Эта величина называется постоянная Фарадея (F).
На законах Фарадея основаны расчеты электрохимических установок, а на их базе созданы счетчики количества электричества (кулонометры, интеграторы тока) и другие устройства.
Электролиз подчиняется уравнениям кинетики электродных процессов.
Дата публикования: 2015-07-22; Прочитано: 360 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
