 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Транспорт двуокиси углерода
|
|
Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт СО2 от тканей к легким. Гемоглобин связывает СО2 сразу после освобождения кислорода (» 15 % всего СО2). В эритроцитах происходит ферментативный процесс образования угольной кислоты из СО2, поступающего из тканей: СО2 + Н2О = Н2СО3. Угольная кислота быстро диссоциирует на НСО3- и Н+. Для предотвращения опасного повышения кислотности должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови. В легких идет обратный процесс. Высвобождающиеся протоны связываются с бикарбонат- ионом с образованием угольной кислоты, которая под действием фермента превращается в СО2 и воду, СО2 выдыхается. Т.о., связывание О2 тесно сопряжено с выдыханием СО2. Это обратимое явление известно как эффект Бора. У миоглобина эффекта Бора не обнаруживается.
Молекулярная основа эффекта Бора
Протоны, ответственные за эффект Бора, высвобождаются в результате разрушения солевых мостиков, которым сопровождается связывание О2, они отсоединяются от остатков His (146) в b-цепях гемоглобина. Наоборот, при высвобождении кислорода вновь формируется структура с солевыми мостиками, при образовании которых происходит присоединение протонов к остаткам His.
Регуляция 2,3-бисфосфоглицератом
Недостаток О2 в тканях приводит к накоплению 2,3-бисфосфоглицерата. Это соединение образуется из 1,3-бисфосфоглицерата, промежуточного продукта гликолиза. Тетрамер гемоглобина связывает одну молекулу ДФГ, которая размещается в центральной области, выстланной остатками все 4-х субъединиц. Объем этой полости достаточен только в том случае, когда разрушены солевые мостики между тетрамерами. ДФГ стабилизирует неоксигенированную форму Hb. С фетальным гемоглобином ДФГ связывается менее прочно, поэтому HbF обладает большим сродством к О2, чем гемоглобин взрослого человека.
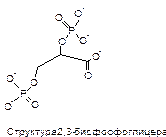
При увеличении концентрации ДФГ в эритроцитах (например, при снижении парциального давления кислорода), снижается сродство О2 к гемоглобину, этим и обуславливается регулирующее действие ДФГ.
Кооперативные изменения конформации олигомерных белков составляют основу механизма регуляции функциональной активности не только Hb, но и большого числа других белков, в том числе аллостерических ферментов.
10. Изофункциональные белки
Белок, выполняющий определенную функцию в клетке, может быть представлен несколькими формами - изофункциональными белками, или изоферментами. такие белки хоть и выполняют одинаковую функцию, но отличаются, константой связывания, что приводит к некоторым различиям в функциональном отношении. Например, в эритроцитах человека обнаружено несколько форм гемоглобина: HbA (96%), HbF (2%), HbA2(2%). Все гемоглобины представляют собой тетрамеры, построенные из протомеров a, b, g, d (HbA -a2b2, HbF - a2g2, HbA2 - a2d2). Все протомеры сходны между собой по первичной структуре, и очень большое сходство наблюдается по вторичной и третичной структурам. Все формы гемоглобинов предназначены для переноса кислорода в клетки тканей, но HbF, например, имеет большее сродство к кислороду, чем HbA. HbF характерен для эмбриональной стадии развития человека. Он способен отнимать кислород у HbA, что обеспечивает нормальное снабжение кислородом плода.
Изобелки - это результат наличия более чем одного структурного гена в генофонде вида.
11. Изменения белкового состава организма
Белковый состав взрослого человека более или менее постоянен, однако возможны некоторые изменения содержания некоторых белков в зависимости от физиологической активности, состава пищи, циклические изменения (биоритмы). При болезнях белковый состав тканей изменяется. Эти проявления болезней называют протеинпатиями. Различают протеинпатии двух типов - наследственные и приобретенные. Наследственные - результат повреждения в генетическом аппарате организма (например, HbS). Приобретенные сопровождают любую болезнь. При приобретенных первичная структура белка не изменяется, изменяется количество белка и его распределение в тканях. Нарушение этих параметров в тканях и жидкостях организма позволяют поставить правильный диагноз.
Дата публикования: 2015-07-22; Прочитано: 216 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
