 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Сырьем для промышленного производства карбамида являются жидкий аммиак и диоксид углерода
|
|
Аммиак NН3. В обычных условиях он представляет собой бесцветный газ с резким удушающим запахом; жидкий аммиак – бесцветная жидкость.
Диоксид углерода СО2
При обычных условиях диоксид углерода – бесцветный газ с кисловатым вкусом. Под давлением 35.5 ат и температуре 00С диоксид углерода конденсируется в бесцветную жидкость, не смешивающуюся с водой, но растворимую в спирте, маслах и эфире.
В производстве карбамида применяется двуокись углерода, являющаяся отходом процесса очистки азото-водородной смеси, направляемой на синтез аммиака.
Качество диоксида углерода, используемого для синтеза карбамида, должно удовлетворять следующим требованиям:
Содержание СО2, %, не менее……………………99
Инертные примеси (Н2, N2, СО, СН4), %, н/б…..1
в том числе водород, %, н/б………………...0.01
Соединения серы, мг/м3, н/б…………………. 1
Влажность, г/м3……………………………….. … 12 –25
Такие жесткие требования по содержанию сернистых соединений в углекислом газе обусловлены тем, что присутствие этих примесей вызывает коррозию аппаратуры и ухудшение качества карбамида.
Получение карбамида
Его получение основано на реакции взаимодействия аммиака с диоксидом углерода:
2NH3 + CO2↔ CO(NH2)2 + H2 O ΔН = —110.1 кДж (2.4.4)
Реакция (2.4.4) — суммарная; она протекает в две стадии. На первой стадии происходит синтез карбамата:
2NH3(г) + CO2(г) ↔ NH2СОО NH4(ж); ΔН =–125,6кДж (2.45)
На второй стадии протекает эндотермический процесс отщепления воды от молекул карбамата, в результате которого и происходит образование карбамида:
NH2СООNH4(ж) ↔ CO(NH2)2(ж) + H2 O(ж); ΔН =15,5кДж (2.4.6)
Реакция образования карбамата аммония — обратимая экзотермическая реакция, протекающая с уменьшением объема. Для смещения равновесия в сторону продукта ее необходимо проводить при повышенном давлении. Для того чтобы процесс протекал с достаточно высокой скоростью, необходимы повышенные температуры. Повышение давления компенсирует отрицательное влияние высоких температур на смещение равновесия реакции в обратную сторону. На практике синтез карбамида проводят при температурах 150-190°С и давлении 15-20 МПа. В этих условиях реакция протекает с высокой скоростью и практически до конца.
Разложение карбамата аммония — обратимая эндотермическая реакция, интенсивно протекающая в жидкой фазе. Чтобы в реакторе не происходило кристаллизации твердых продуктов, процесс необходимо вести при температурах не ниже 98°С [эвтектическая точка для системы CO(NH2)2 - NH2COONH4]. Более высокие температуры смещают равновесие реакции вправо и повышают ее скорость. Максимальная степень превращения карбамата в карбамид достигается при 220°С. Для смещения равновесия этой реакции вводят также избыток аммиака, который, связывая реакционную воду, удаляет ее из сферы реакции. Однако добиться полного превращения карбамата в карбамид все же не удается. Реакционная смесь помимо продуктов реакции (карбамида и воды) содержит также карбамат аммония и продукты его разложения — аммиак и СО2.
Отсюда ясно, что процесс производства карбамида должен состоять из следующих стадий:
1) синтеза карбамида из аммиака и двуокиси углерода;
2) выделения компонентов, не превращенных в карбамид, из его водного раствора и возврат их в цикл или использование в других производствах;
3) получения товарного карбамида из его водного раствора.
Обе стадии процесса превращения аммиака и двуокиси углерода в карбамид возможно и целесообразно проводить при одних и тех же условиях. Наиболее выгодные условия этого процесса определяются глубиной и степенью протекания обеих приведенных реакций, а также физическим состоянием реакционной массы.
Степень превращения СО2 в карбамид зависит от Т, Р, соотношения компонентов реакции, продолжительности процесса и некоторых других факторов. При одновременном протекании обеих стадий синтеза карбамида теплота образования карбамата аммония компенсирует эндотермический эффект реакции его дегидратации и обеспечивает необходимый разогрев смеси до оптимальной температуры. Аммиак и диоксид углерода практически нацело и с большой скоростью превращаются в карбамат аммония. Реакция же дегидратации карбамата аммония, определяющая выход карбамида, обратима. В соответствии с принципом Ле-Шателье повышение температуры благоприятствует протеканию реакции дегидратации карбамата аммония, однако при этом возможно его разложение. Превращение карбамата в карбамид происходит в жидкой фазе. В соответствии с этим процесс синтеза необходимо вести при высокой температуре и соответствующим ей высоком давлении
Для полного использования исходного сырья необходимо либо предусмотреть возвращение непрореагировавших аммиака и диоксида углерода, а также углеаммонийных солей (промежуточных продуктов реакции) в колонну синтеза, т.е. создание рецикла, либо отделение карбамида от реакционной смеси и направление оставшихся реагентов на другие производства, например, на производство аммиачной селитры, т.е. проведение процесса по открытой схеме.
В последнем случае плав, выходящий из колонны синтеза, дросселируют до атмосферного давления; равновесие реакции (6) при температурах 140-150°С практически полностью смещается влево и весь оставшийся карбамат разлагается. В жидкой фазе остается водный раствор карбамида, который упаривают и направляют на грануляцию. Рецикл образовавшихся газообразных аммиака и диоксида углерода в колонну синтеза потребовал бы их сжатия в компрессоре до давления синтеза карбамида. Это сопряжено с техническими трудностями, связанными с возможностью образования карбамата при низких температурах и высоком давлении уже в компрессоре и забивки машин и трубопроводов твердыми частицами.
Поэтому в закрытых схемах (схемах с рециркуляцией) обычно применяют только жидкостной рецикл.
Аммиак вода

|
|

|


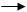



диоксид углерода раствор аммонийных солей

Рис.2.4.1 Принципиальная схема с полным рециклом
На рисунке ниже приведена упрощенная схема крупнотоннажного агрегата синтеза карбамида с жидкостным рециклом и применением стриппинг-процесса. В ней можно выделить узел высокого давления, узел низкого давления и систему грануляции. Водный раствор карбамата аммония и углеаммонийных солей, а также аммиак и диоксид углерода поступают в нижнюю часть колонны синтеза 1 из конденсатора высокого давления 4. В колонне синтеза при температуре 170-190°С и давлении 13-15 МПа заканчивается образование карбамата и протекает реакция синтеза карбамида. Расход реагентов подбирают таким образом, чтобы в реакторе молярное отношение NH3:СО2 составляло 2,8-2,9. Жидкая реакционная смесь (плав) из колонны синтеза карбамида поступает в отдувочную колонну 5, где стекает по трубкам вниз. Противотоком к плаву подают сжатый в компрессоре до давления 13-15 МПа диоксид углерода, к которому для образования пассивирующей пленки и уменьшения коррозии оборудования добавлен воздух в количестве, обеспечивающем в смеси концентрацию кислорода 0,5-0,8%. Отдувочная колонна обогревается водяным паром. Парогазовая смесь из колонны 5, содержащая свежий диоксид углерода, поступает в конденсатор высокого давления 4. В него же вводят жидкий аммиак. Он одновременно служит рабочим потоком в инжекторе 3, подающем в конденсатор раствор углеаммонийных солей из скруббера 2 и при необходимости часть плава из колонны синтеза. В конденсаторе образуется карбамат. Выделяющуюся при реакции теплоту используют для получения водяного пара.
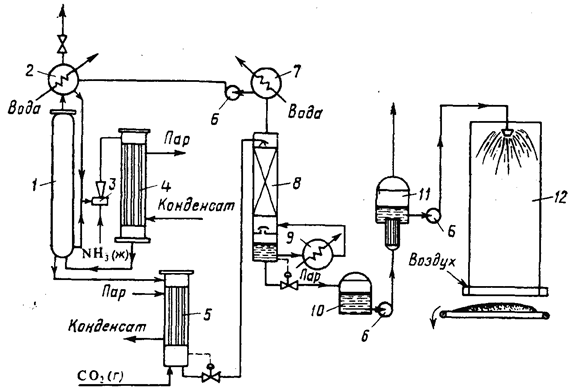

Из верхней части колонны синтеза непрерывно выходят непрореагировавшие газы, поступающие в скруббер высокого давления 2, в котором большая часть их конденсируется за счет водного охлаждения, образуя водный раствор карбамата и углеаммонийных солей.
Водный раствор карбамида, выходящий из отдувочной колонны 5, содержит 4-5% карбамата. Для окончательного его разложения раствор дросселируют до давления 0,3-0,6 МПа и затем направляют в верхнюю часть ректификационной колонны 8. Жидкая фаза стекает в колонне вниз по насадке противотоком к парогазовой смеси, поднимающейся снизу вверх; из верхней части колонны выходят NH3, CO2 и водяные пары. Водяные пары конденсируются в конденсаторе низкого давления 7, при этом растворяется основная часть аммиака и диоксида углерода. Полученный раствор направляют в скруббер 2. Окончательная очистка газов, выбрасываемых в атмосферу, производится абсорбционными методами (на схеме не показана).
70%-ный водный раствор карбамида, выходящий из нижней части ректификационной колонны 8, отделяют от парогазовой смеси и направляют после снижения давления до атмосферного сначала на выпарку, а затем на грануляцию. Перед распылением плава в грануляционной башне 12 к нему добавляют кондиционирующие добавки, например мочевиноформальдегидную смолу, чтобы получить неслеживающееся удобрение, не портящееся при хранении.
Дата публикования: 2014-10-16; Прочитано: 4998 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
