 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Адсорбция на неподвижной поверхности раздела фаз
|
|
Поглощение газов, паров и растворенных веществ в биосистемах широко связано с их адсорбцией на твердых адсорбентах. При адсорбции изменяется химический состав поверхности адсорбента, а количественной характеристикой этого процесса является величина удельной адсорбции Г.
Удельная адсорбция - это равновесное количество поглощаемого вещества, приходящееся на единицу поверхности или массы твердого адсорбента.
В качестве адсорбентов обычно применяют мелкоизмельченные вещества или пористые тела, что обеспечивает большую площадь поверхности раздела фаз, которую, однако, определить часто невозможно. Поэтому удельная адсорбция для твердых адсорбентов преимущественно выражается в молях поглощенного вещества на единицу массы адсорбента:
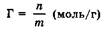
где т - количество адсорбата, моль; т - масса адсорбента, г.
Рассмотрим адсорбцию на твердых адсорбентах газов, паров, а также растворенных веществ из растворов.
Адсорбция газов и паров на твердых адсорбентах является чисто поверхностным процессом, который заключается во взаимодействии молекул адсорбата с поверхностью адсорбента за счет сил Вандер-Ваальса и водородных связей. Количество поглощенного газа или пара твердым адсорбентом в результате адсорбции зависит от следующих факторов: 1) природы и площади поверхности адсорбента; 2) природы поглощаемого газа или пара; 3) концентрации или давления газа или пара; 4) температуры.
1. Адсорбция газов и паров на твердых адсорбентах зависит прежде всего от свободной поверхностной энергии, которая весьма велика для адсорбентов с аморфной структурой (активированный уголь) на выступах, впадинах и в капиллярах, а для кристаллических (оксиды кремния, алюминия) - на ребрах, углах и в трещинах кристаллов. Поэтому адсорбент тем эффективней, чем мельче измельчен и чем выше его пористость. Важной характеристикой твердых адсорбентов является удельная поверхность Syд (м2/г). У непористых адсорбентов (оксиды металлов, соли, сажа) Syд = 0,01-10 м2/г, а у пористых (активированный уголь, силикагель
(Si02)n, цеолиты) - 103-105 м2/г. Процесс активации угля заключается в его обжиге без доступа воздуха или пропарке перегретым паром, при этом увеличивается его пористость вследствие очистки от смол, заполняющих поры, и образования новых пор. В зависимости от природы адсорбенты подразделяются на неполярные (гидрофобные) - сажа, активированный уголь, тальк (3MgO * Н2О • 4Si02), фторопласт - и полярные (гидрофильные) - силикагель ((SiO2)n), алюмогель ((Аl2О3)n), глины, цеолиты.
2. Адсорбируемость газа или пара определяется его сродством к поверхности адсорбента. Полярные вещества лучше адсорбируются на полярных адсорбентах, а неполярные - на неполярныхадсорбентах. При этом, чем больше адсорбат склонен к межмолекулярным взаимодействиям, тем лучше он адсорбируется.
При физической адсорбции из смеси газов или паров лучше адсорбируется тот компонент, который легче сжижается, поскольку его молекулы более склонны к межмолекулярным взаимодействиям.
Например, адсорбируемость газа (Г) на активированном угле при 298 К тем выше, чем выше его температура кипения:
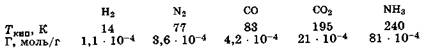
3. Влияние концентрации (или давления) газов или паров на процесс адсорбции имеет сложный характер. Одновременно с адсорбцией протекает десорбция адсорбированных молекул в газовую фазу. При равенстве скоростей этих процессов наступает адсорбционное равновесие. При равновесии количества газа или пара в окружающей среде и на поверхности адсорбента постоянны во времени.
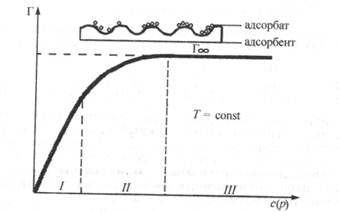
Скорость адсорбции на легкодоступной поверхности больше, а в порах пористых адсорбентов - меньше, причем чем тоньше поры адсорбента, тем меньше скорость адсорбции. Поэтому время установления адсорбционного равновесия на пористых адсорбентах, как правило, велико, что нужно помнить при работе с ними. Графическая зависимость удельной адсорбции Г от концентрации поглощаемого вещества в системе при постоянной температуре называется изотермой адсорбции. Различают изотерму адсорбции при низких концентрациях поглощаемого вещества в системе, когда адсорбция завершается образованием мономолекулярного слоя из молекул адсорбата на поверхности адсорбента, и изотерму адсорбции, охватывающую большие концентрации адсорбата, когда уже происходит полимолекулярная адсорбция.
Рассмотрим изотерму адсорбции газов или паров при невысоких их концентрациях в системе. С увеличением концентрации или давления газа в системе его адсорбция возрастает, но до определенного предела. В этом случае изотерма адсорбции, представленная на рис. 26.2, содержит три участка. При очень малых концентрациях 1 участок изотермы прямолинеен, так как удельная адсорбция Г возрастает практически прямо пропорционально концентрации газов. При больших концентрациях 3 участок изотермы имеет вид горизонтальной прямой, так как удельная адсорбция, достигнув величины 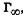 не изменяется. Это предел
не изменяется. Это предел
адсорбции, отвечающий полному насыщению поверхности адсорбента молекулами адсорбата. Средний участок изотермы адсорбции соответствует еще неполному насыщению поверхности.
Закономерности, которые выявляет рассмотренная изотерма адсорбции, описываются теорией Ленгмюра, имеющей следующие основные положения:
- адсорбция молекул происходит не на всей поверхности адсорбента, а только на адсорбционных центрах (вершины неровностей и узкие поры), где имеются участки с наиболее нескомпен-сированными силовыми полями, т. е. Gs — > max;
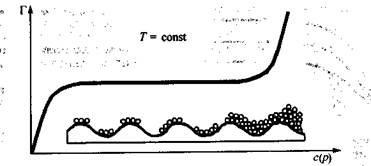 |
Рис. 26.2. Изотерма мономолекулярной адсорбции
Рис. 26.3. Изотерма полимолекулярной адсорбции
- каждый адсорбционный центр может удерживать только одну молекулу адсорбата, при этом адсорбированные молекулы не взаимодействуют со свободными молекулами, что и приводит к образованию мономолекулярного слоя поглощаемого вещества;
- процесс адсорбции обратим и носит динамический характер, так как адсорбированные молекулы удерживаются адсорбционными центрами только в течение определенного промежутка времени, после чего происходит десорбция этих молекул и адсорбция того же числа новых молекул.
Исходя из этих положений, Ленгмюр предложил уравнение адсорбции: 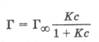
где Г∞ - значение предельной адсорбции; с - равновесная концентрация адсорбата в системе; К - константа адсорбционного равновесия.
Это уравнение хорошо описывает приведенную выше изотерму адсорбции. При очень малых концентрациях, когда с -> 0 и (1 + Кс) = 1, уравнение принимает вид 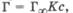 т. е. величина адсорбции прямо пропорциональна концентрации или давлению адсорбата. При больших концентрациях, когда Кс > 1 и (1 + Кс) = Кс,
т. е. величина адсорбции прямо пропорциональна концентрации или давлению адсорбата. При больших концентрациях, когда Кс > 1 и (1 + Кс) = Кс, 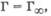 что отвечает насыщению поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой. Уравнение Ленгмюра подобно уравнению Михаэлиса - Ментен для кинетики ферментативных реакций (разд. 5.6).
что отвечает насыщению поверхности адсорбента молекулами адсорбата, так как сформировался мономолекулярный слой. Уравнение Ленгмюра подобно уравнению Михаэлиса - Ментен для кинетики ферментативных реакций (разд. 5.6).
При больших концентрациях адсорбата в системе на изотерме адсорбции после участка, соответствующего насыщению поверхности, обычно наблюдается резкое увеличение удельной адсорбции (рис. 26.3). Это происходит из-за перехода от мономолекулярной адсорбции к полимолекулярной вследствие взаимодействия между адсорбированными молекулами и наслаивания их друг на друга. Для пористых адсорбентов полимолекулярная адсорбция
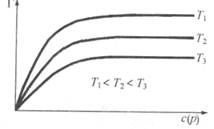 |
Рис. 26.4. Влияние температуры на адсорбцию
наблюдается при адсорбции паров, сопровождающейся их капиллярной конденсацией. Сначала пар адсорбируется в порах, а затем конденсируется в жидкость, заполняя самые тон кие капилляры с образованием вогнутого мениска. Давление насыщенного пара над вогнутым мениском всегда меньше давления пара над плоской поверхностью жидкости. Поэтому в капиллярах пар начинает конденсироваться при более низком его давлении, заполняя прежде всего наиболее мелкие поры.
Таким образом, капиллярная конденсация является вторичным процессом и происходит вследствие притяжения частиц пара к поверхности вогнутого мениска жидкости в порах. Капиллярная конденсация происходит достаточно быстро (в течение нескольких минут).
4. Повышение температуры в соответствии с принципом Ле Шателье уменьшает физическую адсорбцию, так как она является экзотермическим процессом (  Н < 0) (см. рис. 26.4).
Н < 0) (см. рис. 26.4).
Защита от отравляющих веществ при помощи фильтрующего противогаза, конструкция которого была разработана Н. Д. Зелинским, основана на очистке вдыхаемого воздуха путем адсорбции отравляющих газов и паров на твердом адсорбенте. С использованием твердых адсорбентов проводится регенерация воздуха в замкнутых объемах подводных лодок и космических кораблей. Твердые адсорбенты широко используются для осушки газов и регенерации летучих органических растворителей, применяемых в различных технологических процессах. Газовая хроматография на основе твердых адсорбентов применяется для качественного и количественного определения веществ в атмосферном воздухе и воздухе рабочей зоны (разд. 26.7).
Дата публикования: 2014-10-16; Прочитано: 8293 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
