 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Энтропийные закономерности
|
|
Термин «энтропия» имеет двойственное определение. С одной стороны, в термодинамике энтропия есть функция термодинамической системы и характеризует направленность тепловых процессов. С другой стороны, энтропия может быть количественной мерой беспорядка (свободы, разнообразия, хаоса, равновесия) в системе. Эти определения имеют близкородственную суть. Для равновероятных состояний энтропия (Э) выражается следующей формулой:
Э = lnN, где N – число допустимых состояний;
Для системы, которая может находиться в состояниях s1, s2,.... sn и вероятностью, соответственно p(s1),p (s2),....,p(sn), энтропия может быть рассчитана по формуле:
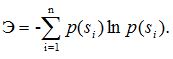
Жёсткая структура, например, кристаллическая решетка вещества или жесткая бюрократическая управленческая структура организации, обладает меньшей энтропией. Структура газообразного вещества или творческого союза музыкантов, в противовес - большей свободой – большим значением энтропии.
Между системой и окружающей средой идет обмен энергией, веществом и информацией. Этот обмен обусловливается разностью свойств системы и окружающей среды - неравновесное состояние системы по отношению к окружающей среде. Процесс обмена прекращается, если свойства системы и окружающей среды уравняются, станут идентичными. Этот процесс всегда подчиняется второму закону термодинамики – однонаправленности самопроизвольных процессов. Энтропия открытой системы может быть изменена только за счет компенсирующего изменения энтропии в другой (других) взаимодействующих системах. В термодинамике этот принцип получил название «принцип компенсации энтропии».
Дата публикования: 2014-10-25; Прочитано: 1454 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
