 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Очистка газов от сероводорода
|
|
Сероводород – бесцветный газ с характерным запахом, хорошо растворим в воде. Один объем воды растворяет в обычных условиях около 3 объемов сероводорода. В водном растворе сероводород ведет себя как слабая кислота, она несколько слабее угольной кислоты. При нагревании растворимость сероводорода в воде понижается.
Сероводород сильно токсичен. При концентрации сероводорода в воздухе 0,004 мг/л ощущается сильный запах. При более высоких концентрациях этого газа в воздухе возможны сильные отравления у людей, вплоть до летальных исходов из-за остановки дыхания. Предельно допустимая концентрация (ПДК) сероводорода в воздухе рабочей зоны составляет 10 мг/м3, а в присутствии углеводородов – 3 мг/м3. Максимальная разовая и среднесуточная ПДК в атмосферном воздухе населенных пунктов равна 0,008 мг/м3
Методы очистки газовых выбросов от сероводорода основаны таких его свойствах, как хорошая растворимость в воде с образованием слабой кислоты, способности окисляться с образованием различных продуктов. Сероводород может гореть на воздухе с образованием серы или оксида серы в зависимости от условий проведения процесса:
2 Н2S + 3 О2 = 2 Н2О + 2 S О2 (в избытке кислорода)
2 Н2S + О2 = 2 Н2О + 2 S (при недостатке кислорода)
Очистка промышленных газовых выбросов от сероводорода может проводиться как мокрым, так и сухим способами. В мокрых методах очистки содержащие сероводород газы контактируют с поглотительными растворами, в состав которых входят компонеты, способные химически взаимодействовать с сероводородом. В сухих способах очистки газов от сероводорода используются сорбенты различной природы. Поглощение сероводорода происходит в результате течения обратимых химических реакций и процессов сорбции – десорбции.
Методы очистки газов от сероводорода
| метод | основные процессы метода |
| Мышьяково-содовый метод очистки газов от Н2S | абсорбция: Na4As2S5O2 + H2S = Na4As2S6O + H2O регенерация сорбента: Na4As2S6O + ½ O2 = Na4As2S5O2 + S |
| Фосфатный метод очистки газов от Н2S | Н2S + К3РО4 = К2НРО4 + КНS |
| Железо-содовый метод очистки газов от Н2S | абсорбция: Н2S + Na2CO3 = NaНS + NaНCO3 3NaНS + 2Fe(OH)3 = Fe2S3 + 3 NaОН + 3Н2О 3NaНS+2Fe(OH)3 =2 FeS + S + 3NaОН+3Н2О регенерация сорбента: 2 Fe2S3 + 6 Н2О + 3 О2 = 4 Fe(OH)3 + 6 S 4 FeS + 6 Н2О + 3 О2 = 4 Fe(OH)3 + 4S |
| Адсорбция Н2S цеолитами. | адсорбция: Н2S + NaA ® Н2S(NaA) регенерация сорбента: Н2S(NaA) ® Н2S + NaA |
| Адсорбция Н2S активированным углем | адсорбция: Н2S + (уголь) + О2 каталитическое окисление: 2 Н2S + О2 = 2 Н2О + 2 S |
Мышьяково-содовый метод очистки газов от Н2S основан на хемосорбции сероводорода тиоарсенатом натрия. Химизм процесса сложен, результирующие реакции могут быть представлены в виде следующих схем:
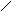
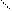
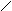
 Na-S S-Na Na-S S-Na
Na-S S-Na Na-S S-Na
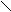
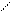

 As-S-As + Н2S ® As-S-As + Н2О
As-S-As + Н2S ® As-S-As + Н2О
Na-S || || S-Na Na-S || || S-Na
Дата публикования: 2014-10-19; Прочитано: 1336 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
