 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Образование малорастворимых соединений
|
|
Образование малорастворимых соединений приводит к уменьшению концентрации окисленной или восстановленной формы и, следовательно, к изменению величины электродного потенциала.
Пример 7.4. Известно, что 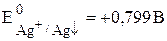 , рассчитайте
, рассчитайте 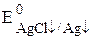
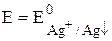
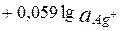
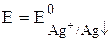
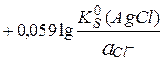
Е = 
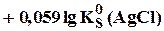
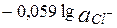
Сумма двух констант в данном выражении, выделенная полужирным шрифтом, представляет собой 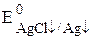
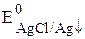 = 0,799 + 0,059lg(1,8×10-10) = 0,23 В
= 0,799 + 0,059lg(1,8×10-10) = 0,23 В
Комплексообразование
Окисленная или восстановленная форма либо они обе вместе могут связываться в комплексные соединения с ионами, присутствующими в растворе. Это приводит к изменению величины электродного потенциала.
Пример 7.5. Известно, что 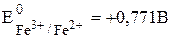 . Рассчитайте величину
. Рассчитайте величину 
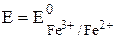
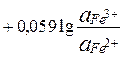

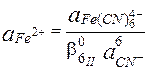
E = 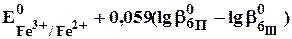 + 0,059
+ 0,059 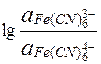
 = 0,771 + 0,059×(36,9 - 43,9) = 0,36 В
= 0,771 + 0,059×(36,9 - 43,9) = 0,36 В
Ион Fe3+ образует более устойчивый цианидный комплекс, чем Fe2+, поэтому величина электродного потенциала пары Fe(CN)63-/Fe(CN)64- меньше, чем у пары Fe3+/Fe2+.
7.4. Расчёт различных констант с использованием электродного потенциала
По величине электродных потенциалов можно рассчитать KS малорастворимого электролита, константу образования комплексного соединения, Ka слабой кислоты и т.д.
Пример 7.6. Рассчитать величину 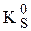 a-модификации CoS, если известно, что
a-модификации CoS, если известно, что 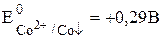 ,
, 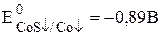

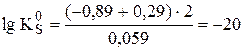
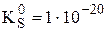
Дата публикования: 2014-10-19; Прочитано: 819 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
