 |
Главная Случайная страница Контакты | Мы поможем в написании вашей работы! | |
Общий (одноименный) ион
|
|
Повышение активности в растворе одного иона, образующегося при растворении малорастворимого электролита, должно привести к уменьшению активности второго, так чтобы их произведение осталось неизменным. Если к раствору добавить некоторое количество хорошо растворимого электролита, содержащего такой же ион, что и малорастворимый электролит, то растворимость малорастворимого электролита уменьшится. Такое явление называется эффектом общего (одноименного) иона.
Пример 6.4. Рассчитать растворимость иодата бария в 5,0×10-2 М NaIO3.
Концентрация иодат-ионов, образовавшихся при растворении иодата бария, значительно меньше, чем 5,0×10-2 моль/л, поэтому можно принять, что 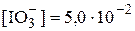 моль/л. Для расчётов воспользуется полученным в примере 6.3 концентрационным произведением растворимости иодата бария при I = 5,0×10-2.
моль/л. Для расчётов воспользуется полученным в примере 6.3 концентрационным произведением растворимости иодата бария при I = 5,0×10-2.
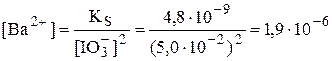 моль/л
моль/л
По сравнению с примером 6.3 растворимость иодата бария уменьшилась примерно на 3 порядка. Таким образом, влияние эффекта общего иона на растворимость сказывается значительно сильнее, чем влияние солевого эффекта.
При увеличении концентрации иона-осадителя растворимость осаждаемого иона уменьшается. Исходя из этого можно сделать неверное заключение о том, что при добавлении бесконечно большого его избытка растворимость интересующего нас соединения станет бесконечно малой. Молекулярная растворимость не зависит от концентрации иона осадителя в растворе. Она представляет собой предел, ниже которого растворимость осаждаемого соединения уменьшить при добавлении избытка иона-осадителя невозможно. В ряде случаев добавление значительного избытка общего иона приводит к повышению растворимости, например, за счёт протекания побочных реакций комплексообразования (рис. 6.4).
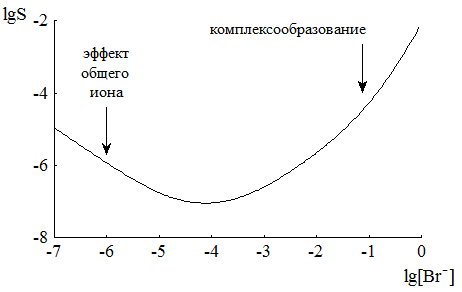
Рис. 6.4 Зависимость растворимости AgBr (размерность S - моль/л) от lg[Br-]
Для малорастворимых кислот и оснований одноименными ионами в водных растворах являются, соответственно, H3O+ и OH-.
Пример 6.5. При каком значении рН начнёт осаждаться Fe(OH)3 (KS = 6,3×10-38) из раствора с концентрацией Fe3+ 1,0×10-2 моль/л? При каком значении рН осаждение ионов железа можно считать полным?
Будем считать, что 1,0×10-2 М - это равновесная концентрация ионов Fe3+.
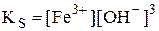
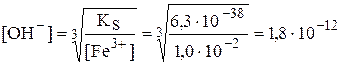 моль/л
моль/л
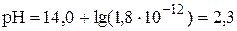
Осаждение считается полным, если остаточная концентрация осаждаемого иона в растворе становится меньше, чем 1×10-6 моль/л. Осаждение Fe3+ можно считать полным при рН > 3,6.
Дата публикования: 2014-10-19; Прочитано: 2127 | Нарушение авторского права страницы | Мы поможем в написании вашей работы!
